Как найти теплоемкость при постоянном давлении
Пусть нагревание происходит в условиях, когда объем остается постоянным
(V = const). Соответствующая молярная теплоемкость называется теплоемкостью при постоянном объеме, или изохорической теплоемкостью, и обозначается CV:
 (82)
(82)
Так как теплота при этом тратится только на изменение внутренней энергии dU, то δQ = dU и
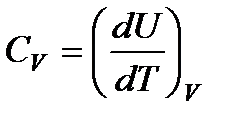 (83)
(83)
Отсюда dU = CV dT. Уравнение закона сохранения энергии (80) можно теперь переписать в виде
Следовательно, подводимое к телу тепло расходуется на изменение температуры dT (изменение внутренней энергии) и изменение объема dV (с этим связана внешняя механическая работа).
Если при нагревании постоянным остается давление, то теплоемкость называется теплоемкостью при постоянном давлении Ср (ее можно также называть изобарической теплоемкостью):


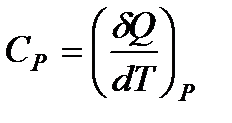 .
.
Пользуясь результатами кинетической теории газов, легко вычислить молярные теплоемкости идеального газа.
Для идеального одноатомного газа, как мы видели, внутренняя энергия моля равна U = 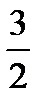 RT; значит,
RT; значит,
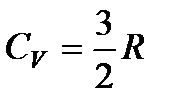 . (85)
. (85)
Если разделить это значение молярной теплоемкости на число молекул в грамм-молекуле, т. е на число Авогадро, то получим тот средний вклад, который каждая молекула вносит в теплоемкость газа:
 .
.
Следовательно, при повышении температуры на 1 К энергия каждой молекулы в среднем возрастает на 
 джоулей.
джоулей.
Теплоемкость Cp идеального газа при постоянном давлении больше теплоемкости CV при постоянном объеме на величину работы, которую совершает моль газа, расширяясь при нагревании на 1К. Работа эта равна 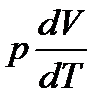 . Таким образом,
. Таким образом,
 . (86)
. (86)
Но для моля идеального газа pV = RT, поэтому 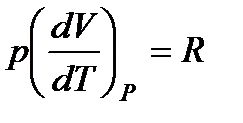 и
и
 . (87)
. (87)
Из формул (85) и (87) видно, что теплоемкость при постоянном давлении превосходит теплоемкость при постоянном объеме на величину R:
Уравнение (88) называетсяуравнением Роберта Майера. Из него вытекает физический смысл газовой постоянной:
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8829 —  | 7543 —
| 7543 —  или читать все.
или читать все.
78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Теплоемкости при постоянном давлении и постоянном объеме
При сообщении телу некоторого количества теплоты изменяется его температура (за исключением агрегатных превращений и вообще изотермических процессов). Характеристиками такого изменения являются различные теплоемкости: теплоемкость тела CT, удельная теплоемкость вещества c, молярная теплоемкость C.
Понятия теплоемкости тела и удельной теплоемкости рассмотрены тут.
Молярная теплоемкость C — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
Единицей молярной теплоемкости в СИ является джоуль на моль-Кельвин (Дж/моль·К).
Удельная теплоемкость связана с молярной соотношением
В отличие от такой, например, характеристики вещества, как его молекулярная масса Mr удельная теплоемкость вещества не является неизменным параметром. Удельная теплоемкость может резко изменяться при переходе вещества из одного агрегатного состояния в другое. Так, вода в газообразном состоянии имеет удельную теплоемкость 2,2·10 3 Дж/кг·К а в жидком 4,19·10 3 Дж/кг·К .
Теплоемкость зависит и от условий, при которых происходит передача теплоты телу. Последнее особенно относится к газам. Например, при изотермическом расширении газа ему передается некоторое количество теплоты Q > 0, а ΔΤ = 0. Следовательно, удельная теплоемкость газа при изотермическом процессе
При адиабатном сжатии (расширении) газ не получает теплоты и не передает ее окружающим телам (Q = 0), а температура газа изменяется (ΔΤ ≠ 0). Следовательно, удельная теплоемкость газа при адиабатном процессе
Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. В первом случае теплоемкость называется теплоемкостью при постоянном объеме или изохорной теплоемкостью (cV, CV), во втором — теплоемкостью при постоянном давлении или изобарной теплоемкостью (cp, Cp).
Если объем не изменяется (ΔV = 0), то работа, совершенная газом, так же равна нулю (А = 0). Согласно первому закону термодинамики
Delta U = C_
Следовательно, теплоемкость при постоянном объеме равна изменению внутренней энергии газа при изменении температуры на 1 К.
Если газ идеальный, то в формуле (2)
Delta U = frac i2 frac mM R Delta T .)
Тогда молярная теплоемкость при постоянном объеме (
Delta U_M = frac i2 R Delta T) — изменение внутренней энергии 1 моль газа. Из этих равенств теплоемкость газа при постоянном объеме — (
C_
Если газ нагревается при постоянном давлении, то согласно первому закону термодинамики
A = p Delta V = frac mM R Delta T).
Тогда теплоемкость газа при постоянном давлении
C_ <Delta T>= frac<Delta U> <Delta T>+ frac mM R = C_
Молярная теплоемкость при постоянном давлении:
C_p = C_V + R) — уравнение Майера; (
C_p = frac i2 R + R = frac R .)
Таким образом, теплоемкость при постоянном давлении всегда больше теплоемкости при постоянном объеме. Их отношение равно
где γ — показатель адиабаты (коэффициент Пуассона).
Из-за малости величины коэффициента объемного расширения твердых и жидких тел работой, совершаемой ими при нагревании при постоянном давлении, можно пренебречь и считать, что теплоемкости при постоянном объеме и постоянном давлении практически совпадают. Поэтому теплоемкость твердых и жидких тел при заданной температуре может считаться вполне определенной величиной.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 159-161.
1.2.1.Вычислить удельные теплоемкости при постоянном давлении и при постоянном объеме неона и водорода, принимая газы за идеальные.
Решение. Между молярными и удельными теплоемкостями идеального газа при постоянном давлениии и при постоянном объеме существует связь:
 , а
, а  .
.
Таким образом, для удельныхтеплоемкостей имеем:
 а
а  .
.
Зная, что неон одноатомныйгаз длянего число степеней свободы i=3, m=20×10 -3 кг/моль, а водород двухатомный газ для него число степеней свободы i=5, m=27×10 -3 кг/моль. Подставляя в каждую из выше записанных формул значения и значение универсальной газовой постоянной R=8,31 Дж/(моль×К), вычисляем удельные теплоемкости для:



 .
.
1.2.2. Найти отношение удельных теплоемкостей при постоянном давлении и постоянном объеме для кислорода.
Решение. Отношение удельных теплоемкостей при постоянном давлении и постоянном объеме идеального газа равно отношению его молярных теплоемкостей при постоянном давлении и постоянном объеме:

Зная, что молярные теплоемкости при постоянном давлении и при постоянном объеме связаны с числом степеней свободы и равны
 и
и 
Для отношения удельных теплоемкостей будем иметь

Кислород двухатомный газ, следовательно, число степеней свободы i=5. Подставляя значение i в вышезаписанную формулу, имеем:

1.2.3. Удельная теплоемкость некоторого двухатомного газа равна 14,7 кДж/(кг×К). Найти молярную массу этого газа.
Решение. Известно, что удельная теплоемкость при постоянном давлении связана с молярной теплоемкостью газа:

Молярная теплоемкость при постоянном давлении

где I – число степеней свободы газа.


Подставляяв полученную формулу значения данных в условии задачи величин, сучетом того, что для двухатомного газа i=5, будем иметь:

1.2.4. Вычислить удельные теплоемкости при постоянном объеме и постоянном давлении смеси неона и водорода, если массовые доли неона и водорода составляют w1=80% и w2=20% соответственно. Удельные теплоемкости для неона сv=6,24×10 2 Дж/(кг×К), сp==1,04×10 3 Дж/(кг×К); для водорода-сv=1,04×10 4 Дж/(кг×К), сp==1,46×10 4 Дж/(кг×К).
Решение. В общем случае количество тепла необходимого для нагревания смеси газов, например, при нагревании в условиях постоянного объема от температуры Т1 до температуры Т2 равна:

где сv(см) – удельная теплоемкость смеси;
С другой стороны это количество тепла может быть вычисленопо формуле:

где Q1 и Q1 – соответственно количество тепла, которое необходимо
сообщить, чтобы изменить температуру неона и водорода в отдельности;
сv1 и сv2 – удельные теплоемкости неона и водорода при постоянном объеме;
m1 и m2 – массы неона и водорода.
Таким образом имеем:



где  и
и  – массовые доли неона и водорода соответственно.
– массовые доли неона и водорода соответственно.
Подставляячисленные значения для удельнойтеплоемкости смеси неона иводорода при постоянномдавлении, будемиметь:

Аналогично можно получить формулу для определения удельной теплоемкости смеси неона и водорода при постоянном давлении:

Подставляя численные значения для удельной теплоемкости смеси при постоянном давлении, будем иметь:

1.2.5. Кислород массой 2 кг занимает объем V1=1 м3 и находится под давлением p1=0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V2=3 м 3 , а затем при постоянном объеме до давления p3=0,5 МПа. Найти изменение внутренней энергии газа.
Решение. Изменение внутренней энергии газа
где cv=iR/2m – удельная теплоемкость при постоянном объеме;
m – молярная масса газа;
DТ=(Т2 – Т1) – изменение температуры газа в конечном и начальном состояниях;
i=5 – число степеней свободы (кислород двухатомный газ).
Температуру газа в начальном и конечном состояниях можно определить из уравнения Менделеева–Клапейрона:
 .
.
Для начальной температуры
 .
.
Для конечной температуры

Тогда изменение внутреннейэнергиигаза

Подставляячисленные значения, будем иметь

1.2.6. Масса m=10 г кислорода находится при давлении p=0,3 МПа и температуре 10 o С. После нагревания при постоянном давлении газ занял объем V2=10 л. Найти количество теплоты Q, полученное газом, и энергию теплового движения молекул газа W до и после нагревания.
Решение. Количество теплоты Q, полученное газом в процессе нагревания

где  – молярная теплоемкость газа при постоянном давлении;
– молярная теплоемкость газа при постоянном давлении;
i=5 – число степеней свободы (кислород двухатомный газ);
R=8,31 Дж/(моль7К) – универсальная газовая постоянная;
m=0,032 кг/моль – молекулярная масса кислорода;
T1 и T2 – температуры газа в начальном и конечном состояниях. Для определения температуры газа в конечном состоянии воспользуемся соотношением между температурой и объемом газа, нагреваемого в условиях постоянного давления:


Воспользовавшись уравнением Менделеева–Клапейрона:

находимобъем газа в начальном состоянии:

Для конечной температуры будем иметь соотношение:

Подставляя численные значения, определяем конечную температуру газа:

Подставляячисленные значения находим количество теплоты, полученное газом в процессе нагревания:

Энергию теплового движения молекул газа можно определитьпо формуле

где CV=iR/2 – молярная теплоемкость газа при постоянном объеме.
Таким образом, для энергии теплового движения молекул газа в начальном состоянии имеем:

в конечном состоянии:
 .
.
1.2.7. Кислород массой 2 кг занимает объем V1=1 м 3 и находится под давлением p1=0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V2=3 м 3 , а затем при постоянном объеме до давления p3=0,5 МПа. Найти изменение внутренней энергии газа, совершенную им работу и теплоту, переданную газу.
Решение. Известно, что изменение внутренней энергии газа пропорционально изменению его температуры, при этом

Из уравнения Менделеева-Клапейрона

можно определить температуры, характерные для соответствующих состояний:
 .
.
Таким образом, температура газа в начальном состоянии
Следовательно, для изменения внутренней энергии газа при его переходе из начального состояния в конечное состояние, имеем:

В процессе перехода газ совершал работу
где A1 – работа газа, совершенная при переходе в условиях постоянного давления;
A2 – работа газа, совершенная при переходе в условиях постоянного объема.
Работа газа, совершенная при переходе в условиях постоянного давления определяется соотношением:

а работа газа, совершенная при переходе в условиях постоянного объема:

Таким образом, в данном случае

Количество тепла, переданного газу равно сумме изменения его внутренней энергии и работы, совершенной им:

Проверив размерность и подставив численные значения величин, будем иметь
Т1=0,2×10 6 ×1×32×10 -3 /8,31×10 3 ×2=385 К;
Т2=0,2×10 6 ×3×32×10 -3 /8,31×10 3 ×2=1155 К;
Т3=0,5×10 6 ×3×32×10 -3 /8,31×10 3 ×2 =2888 К;
DU=5×2×8,31×(2888-385)/2×32×10 -3 =3,25×10 3 Дж;
A=2×8,31×(1155-385)/32×10 -3 =0,4×10 3 Дж;
Q=3,25×10 3 +0,4×10 3 =3,65×10 3 Дж.
1.2.8. Масса 12 г азота находится в закрытом сосуде объемом
V=2 л при температуре t=10 o С.После нагревания давление в сосуде стало равным p=1,33 МПа. Какое количество теплоты Q сообщено газу при нагревании?
Решение. Так как объем газа не изменился, то сообщенное ему количество теплоты пошло на изменение его внутренней энергии
которое в свою очередь можно определить так:
где Cv=iR/2 – молярная теплоемкость азота при постоянном объеме.
Для определения конечной температуры T воспользуемся тем, что принагревании газав условиях постоянного объема отношение давлений пропорционально отношению его температур в начальном и конечном состояниях p1/p2=T1/T2.
Начальнoe давление определяем из уравнения Менделеева-Клапейрона, записанного для первоначального состояния:
Так как по условию задачи V1=V1=V, то для конечной температуры имеем:
Подставляя значение T2 в формулу изменения внутренней энергии, которое равно количеству тепла, сообщенному газу, окончательно получим:
Размерность полученного результата очевидна. Численное значение Q равно
Q=4,13×10 3 Дж=4,13 кДж.
1.2.9. Баллон емкостью V =20 л с кислородом при давлении p =100 ат и температуре t=7 o С нагревается до t=27 o С. Какое количество теплоты при этом поглощает газ?
Решение. Поскольку коэффициенты теплового расширения для твердых тел значительно меньше (приблизительно в сто раз), чем для газов, в условиях данной задачи можно пренебречь расширением баллона и считать процесс нагревания газа изохорным.
При изохорных процессах, подводимое к системе количество тепла идет на изменение ее внутренней энергии.
Из определения молярной теплоемкости следует, что элементарное количество теплоты, сообщенное телу при повышении его температуры на dT, равно: dQ=CVdT.
Число молей найдем из уравнения газового состояния (Менделеева-Клапейрона) n=m/m=p1V/RT1.
Так как газ нагревается при постоянном объеме, то С=СV, где СV=iR/2.
Подставив значения n и СV в формулу для элементарного количества тепла, получим:

Отсюда, интегрируя и учитывая при этом, что все величины i, p1, T1, V – постоянные, найдем полное количество теплоты, поглощенное газом при нагревании от T1 до T2, которое численно и будет равно изменениюего внутренней энергии:
Проверив размерность, подставив в полученную формулу значения входящих величин в системе СИ, произведем вычисления:
DU=5×9,8×10 5 ×2×10 -3 (300-280)/2×280=35×10 3 Дж=35 кДж.
Дата добавления: 2014-12-30 ; просмотров: 17191 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ

